Aby badać świat w skali mikro, trzeba najpierw wiedzieć czym chce się badać. O ile jeszcze zwykła mikroskopia, jak w przypadku oglądania preparatów biologicznych takich jak komórka, używa do tego falowych własności światła, o tyle schodząc do skali nanometrowej sprawa nie jest już taka oczywista. Jak się okazuje, to co uważaliśmy za falę może być cząstką, a to co powinno być cząstką może być falą. Czy obiekty mogą być równocześnie jednym i drugim? Artykuł ten przedstawia krótką wycieczkę po historycznych kamieniach milowych w dochodzeniu do zrozumienia zjawisk świata mechaniki kwantowej.
XVII wiek
O ile sama koncepcja może wydawać się niedorzeczna i wręcz zwariowana, o tyle z wynikami doświadczeń nikt już nie dyskutuje. Wszystko zaczęło się dość dawno, bo w XVII wieku, gdy Isaac Newton i jemu współcześni zajmowali się nad badaniem światła i tego czym może być. Newton stwierdził że jest zbiorem cząstek, jego oponenci jak np. Christiaan Huygens twierdzili że światło jest falą. O ile autorytet Newtona był na tyle silny, aby skłaniać się do jego wersji, o tyle z biegiem czasu doświadczenia sugerowały jednak, że to jednak nie korpuskuły.
Doświadczenie Younga

Zjawisko interferencji Autor: Aleksandr Berdnikov
Gwóźdź do trumny wersji korpuskularnej natury światła wbił Thomas Young, który na początku XIX wieku dokonał dość prostego, aczkolwiek bardzo ważnego eksperymentu, który bezdyskusyjnie wykazał falową naturę światła. Przepuszczając światło przez najpierw pojedynczą, a późnej dwie szczeliny wykazał, że na ekranie pojawiają się prążki interferencyjne, które są domeną zjawisk o naturze falowej. Korpuskuły po prostu nie są w stanie interferować. Doświadczenie te potwierdziło również słuszność zasady Huygensa, która mówi, że punkt do którego dotrze czoło fali jest źródłem nowej fali kulistej.
Teoria Maxwella

James Clerk Maxwell,
The Royal Society
Kolejny bardzo ważnym krokiem była unifikacja zjawisk elektrycznych i magnetycznych jako jednego, spójnego oddziaływania elektromagnetycznego. W wyniku matematycznych rozważań, których wisienką na torcie były tzw. Równania Maxwella, był również pewien szczególny „efekt uboczny” tej teorii – przewidywała istnienie pewnych fal, które opisywały rozchodzenie się pól elektrycznych i magnetycznych. Co ciekawsze, te nowe, wyprowadzone matematycznie fale elektromagnetyczne, według wzorów miały propagować się z prędkością równą… prędkości światła. Prędkość ta była już współcześnie żyjącym dość dobrze oszacowana, tym bardziej więc nie uważano że to przypadkowa zbieżność wartości. W ten oto sposób, na podstawie teorii Maxwella, istnienie fal elektromagnetycznych zademonstrował doświadczalnie w 1886 roku Henrich Hertz i stało się jasne, że światło to właśnie fala elektromagnetyczna.
Efekt fotoelektryczny
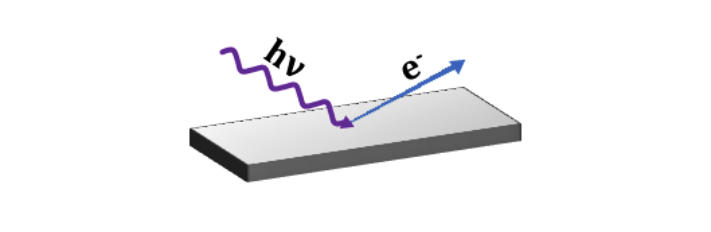
Wydawać by się mogło, że jeżeli chodzi o naturę światła to została postawiona wreszcie końcowa kropka. Wszystko się zgadzało, doświadczenie było poparte teorią, a teoria przewidywała kolejne wyniki doświadczalne. Wyglądało to po prostu logiczne, spójne i było po prostu eleganckie. Cały spokój i harmonię zaburzyło kolejne doświadczenie związane z efektem fotoelektrycznym. Zjawisko to polega na naświetlaniu światłem o ustalonej częstotliwości (głównie ultrafioletem) metalowej powierzchni i obserwacji wybitych elektronów. Trzeba też dodać, że zjawisko to było badane w podobnych czasach co odkrycie elektronu jako cząstki elementarnej. W skrócie problem był taki, że liczba wybitych elektronów nie zależała od natężenia światła, ale od ich częstości. Żeby to zobrazować, wystarczy sobie wyobrazić bardzo silne światło zielone, bardzo jasne, wręcz oślepiające, oraz bardzo słabe, ledwie zauważalne światło fioletowe (pomijając to że już ocieramy się o granicę detekcji dla oka). Wynik eksperymentu będzie taki, że światło zielone mimo swojej ogromnej intensywności nie wybije żadnego elektronu, a fioletowe światło o znikomej intensywności pokaże nam wyraźnie wzrost prądu generowany przez wybite elektrony. Skoro światło jest falą, dlaczego tak się dzieje? Przecież moc fali jest związana z jej amplitudą. Skoro mamy dużą intensywność, czemu nie mamy dużo wybitych elektronów? Jak się okazało, wytłumaczenie tego „paradoksu” wymagało prostej, ale rewolucyjnej koncepcji – światło ma charakter korpuskularny. Dokonał tego Albert Einstein, dając fizyczny charakter cząstkom świata – fotonom (chociaż wtedy nie używano jeszcze tej nazwy). Warto było, ponieważ za wyjaśnienie efektu fotoelektrycznego Einstein otrzymał Nagrodę Nobla z fizyki w 1921 roku.
Kwanty światła
Autor: JabberWok
Kwanty światła po raz pierwszy wprowadził na początku XX wieku Max Planck, ratując matematyczny model promieniowania ciała doskonale czarnego. Wprowadził we wzorze warunek, że energia jest emitowana tylko w postaci dyskretnych, nieciągłych „paczek”. Początkowo Planck sam nie był do końca przekonany o fizyczności swojego pomysłu, traktował to bardziej jako matematyczna sztuczka, dzięki której teoria zgadza się z doświadczeniem. Jednak konsekwencje tego podejścia wywróciły całą fizykę do góry nogami i zapoczątkowały fizykę kwantową. Właśnie koncepcję „paczek”, czyli kwantów światła, które dziś nazywamy fotonami wykorzystał Einstein do wytłumaczenia efektu fotoelektrycznego. Energia fotonu jest zależna od jego częstotliwości, a elektron w materiale potrzebuje określonej energii, aby móc go wybić z jego powierzchni. Gdy fala ma odpowiednią energię – czyli częstotliwość, a nasze oczy rejestrują to jako inny kolor – wtedy dopiero następuje wybicie elektronu. Nie ważne jak często będziemy bombardować fotonami o zbyt małej energii (duża intensywność) to nie wybijemy elektronu gdy nie zostanie przekroczona wartość graniczna, tzw. praca wyjścia. Wystarczy natomiast niewiele fotonów o wysokiej częstości, których energia przekroczy pracę wyjścia – wtedy mamy pewność że zostanie elektron wybity. W ten oto sposób, doświadczenie zaczęło sugerować, że światło jest jednak bardziej ziarniste, niż ciągłe…
Efekt Comptona
Arthur Compton
Kolejnym zjawiskiem, które narobiło sporo zamieszania był efekt Comptona, którego wyniki zostały opublikowane w 1923 roku. Zjawisko to tłumaczy rozpraszanie promieniowania rentgenowskiego na swobodnych (lub na elektronach, których energia wiązania w atomie jest o wiele mniejsza niż energia promieniowania). Aby zgodnie z doświadczeniem opisać zmianę kierunku promieniowania trzeba było założyć, że foton przenosi pęd i wymienia go przy zderzeniu z elektronem, zmieniając kierunek swojego przemieszczania się, co można zapisać w zależności uwzględniającej kąt rozproszenia. Coś mniej więcej jak zderzające się ze sobą kule bilardowe – typowe zjawisko korpuskularne. Pojawił się jednak inny problem – przy wymianie pędu i zmianie kierunku ruchu, zmieniała się też energia, czyli również długość fali, a to już korpuskułom nie przystało…
Falowa natura cząstek

Louis de Broglie
Wspomniane wcześniej wyniki doświadczeń i wniosków z teorii, pokazujące charakter falowy jak i korpuskularny światła zaczął niepokoić fizyków na tyle, że nie mogli uznawać wprowadzone przez Plancka kwanty światła jako twór czysto matematyczny, ponieważ w sposób zauważalny manifestował swoje istnienie w doświadczeniach. Pojawiła się pewna nieśmiała propozycja wysunięta przez Louisa de Broglie’a w 1924 roku, która łączyła pęd – wartość typową dla cząstek z długością fali promieniowania. Wszystko to w dość prostym wzorze, wiążącym stałą Plancka h, z pędem, czyli masą (m) i prędkością obiektu (v):
![]()
Oznaczało to, że dla danej cząstki o zadanym pędzie odpowiada pewna fala o określonej długości (i odwrotnie). W przypadku rzeczy codziennych, takich jak cegła czy szklanka z wodą, długość takiej fali jest mniejszy niż rozmiary protonu. Jednak zmniejszając wstawiając do wzoru masę elektronu i jego prędkość (czyli pęd), uzyskano długość fali o rozmiarach, które można już zmierzyć. Zaczęto więc szukać czy elektrony mogą przejawiać charakter falowy i czy będzie to pasowało do propozycji de Broglie’a.
Doświadczenie Davissona-Germera
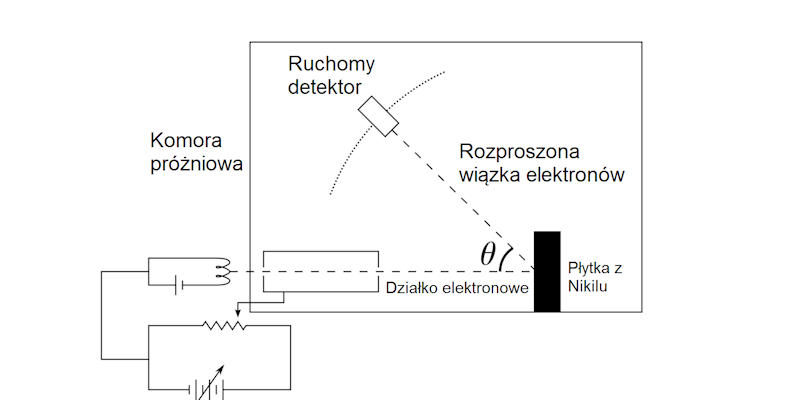
Schemat doświadczenia Davissona-Germera. Autor: SzymonŁysoń
Eksperymentem, który pokazał, że elektron może zachowywać się jak fala, było doświadczenie związane z rozpraszaniem elektronów, które zderzały się z materiałem krystalicznym, który działał jak siatka dyfrakcyjna. Znając pęd elektronów oraz stałą sieci kryształu, można było przewidzieć jak powinna zachować się fala o długości przewidzianej przez de Broglie’a, która by padała na odpowiednią siatkę dyfrakcyjną. Opublikowane w 1927 roku wyniki eksperymentu potwierdziły koncepcje fal materii, torując drogę koncepcji dualizmu korpuskularno-falowego w fizyce.
To wszystko pasuje w mechanice kwantowej
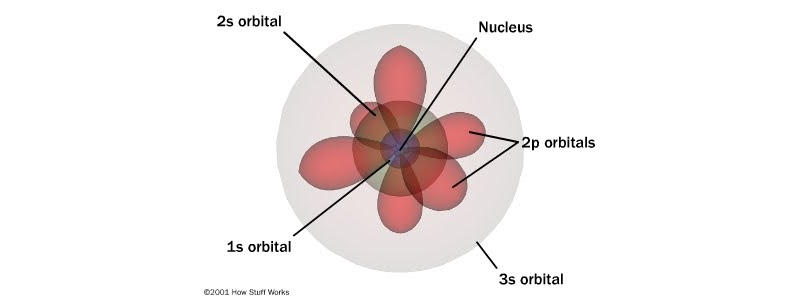
Model atomu Schrödingera
O ile obiekty mające charakter zarówno falowy jak i korpuskularny są dość ciężkie dla naszej intuicji, o tyle mechanika kwantowa bardzo dobrze poradziła sobie z tą koncepcją. Opis cząstek bazujący na pomyśle de Broglie’a umożliwił stworzenie modelu atomu bazującego na tym, że stabilna powłoka elektronowa jest związana z falą stojącą (tzw. model atomu Schrödingera), a funkcja falowa i wynikająca z niej gęstość prawdopodobieństwa tylko przypieczętowała ten sposób patrzenia na cząstki. Stało się jasne, że to skala, rozmiar i pęd decydują o tym, jakich własności powinniśmy spodziewać się w naszym eksperymencie.





